AOA体育官方网站近日,江苏省药品监督管理局发布了《关于部分医疗器械生产业暂停生产的公告》(以下简称《公告》)
公告指出,江苏省药品监督管理局于2022年5月9日至7月15日,对存在质量抽验不合格,不良事件、投诉举报多,未开展质量体系自查或自查零缺陷,以及质量体系运行差等情况的34家医疗器械生产企业进行了交叉飞行检查。
经检查和风险会商,南京道芬电子有限公司、苏州安梦医疗设备有限公司、江苏玉尊医用眼镜有限公司、常州海豚医疗科技有限公司、常州市华康医疗器械有限公司、扬州慧科电子有限公司、扬州市晶星乳胶厂、连云港星致誉医疗器械有限公司、连云港奥凯医疗设备科技有限公司等9家企业申请暂停生产并进行整改。
事实上,除了上述的江苏省药品监督管理局组织的飞检之外,2022年以来,全国多地的医疗器械大检查工作一直在持续进行。
近期,河南省、江西省、陕西省、甘肃省等地的医疗器械企业监督检查结果也相继出炉。近150家企业生产产品存在不合格项目,未能通过检查,面临罚款、责令改正等行政处罚。
值得注意的是,宇安(河南)控股、洛阳市浩洋服饰、河南怡众等企业生产的产品因“无菌”不合格,在多省检查中频现。
另外,近日,福建省药监局也公开一起医疗器械生产企业行政处罚信息。据资料显示,福建天恩医药科技有限公司生产的一次性使用医用口罩因通气阻力不合格,被责令改正,没收违法所得26448.74元;处货值金额34698元的5.5倍罚款190839元,合计217287.74元。
9月22日,合肥市市场监管局公布2022年民生领域案件查办“铁拳”行动典型案例(第三批),其中,合肥松海医疗器械有限公司因未经许可生产医用一次性防护服,被市场监管部门做出相关处罚:1、没收无证生产医用一次性防护服6800件;2、没收生产工具及系列生产原料;3、没收违法所得:35360元;4、罚款:6324000元。
从上述各个地区的医疗器械大检查中,能够明显看出,现阶段在医疗器械抽检常态化推进下,医疗器械检查的范围也逐渐从生产、流通到使用全方面监管。
今年5月1日起,修订后的《医疗器械生产监督管理办法》(以下简称办法)、《医疗器械经营监督管理办法》正式开始施行。
两个办法严格贯彻落实“四个最严”要求,落实《医疗器械监督管理条例》规定,全面落实医疗器械注册人备案人制度,优化行政许可办理流程,强化监督检查措施,完善监督检查手段,夯实企业主体责任,并进一步加大对违法行为的处罚力度。
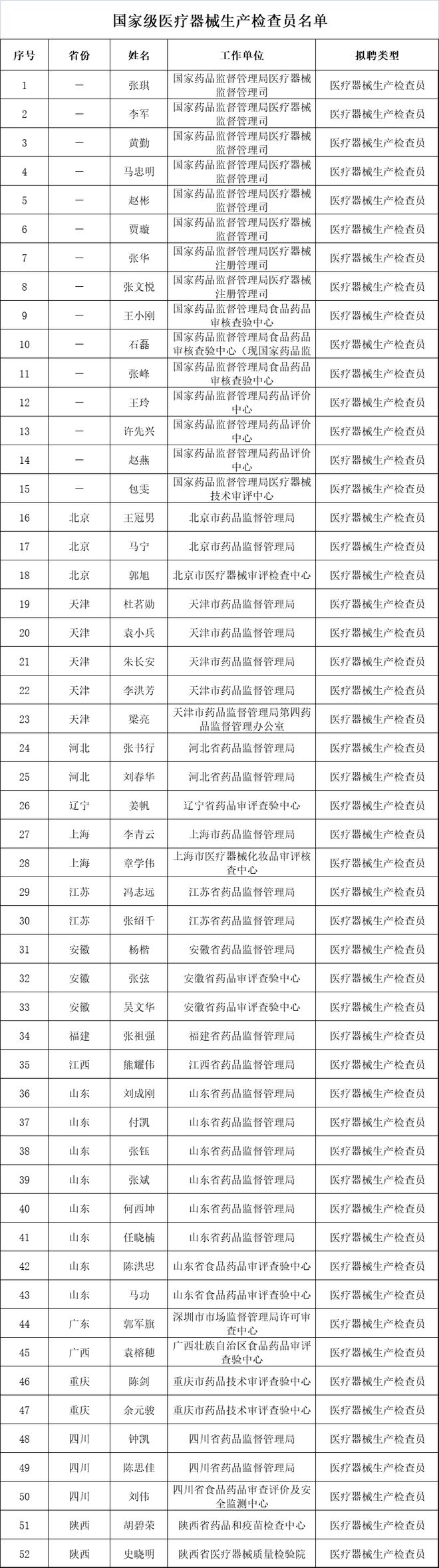
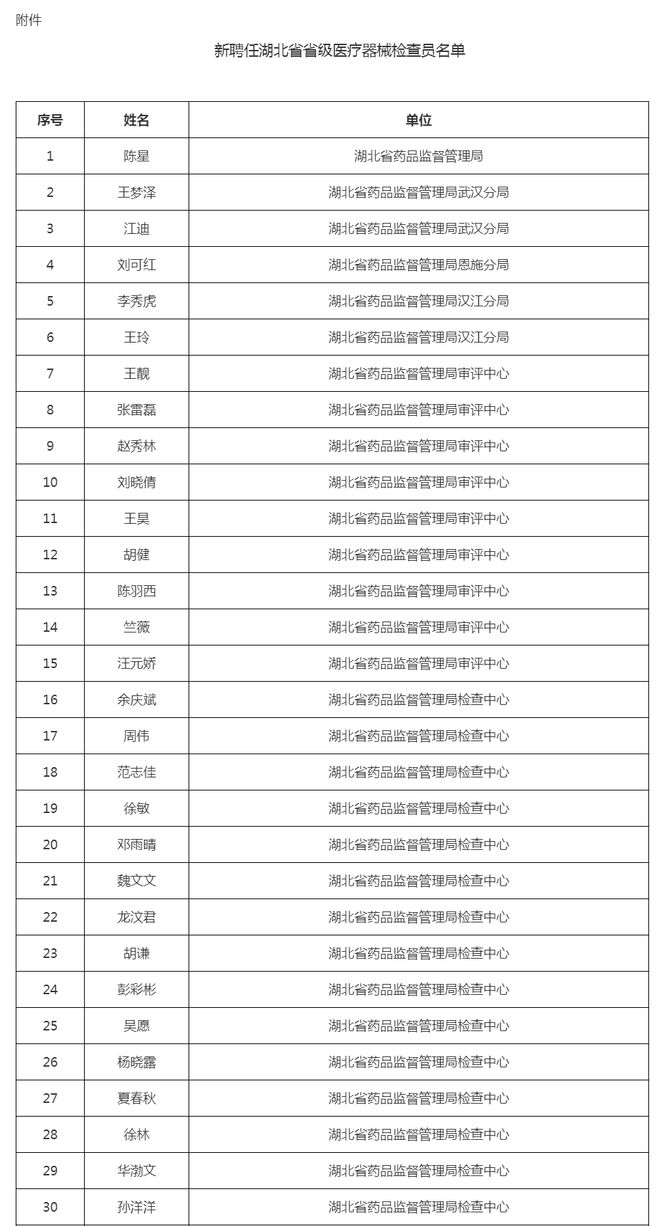
为了更好的落实新版管理办法,近期,国家药品监督管理局核查中心公布《关于聘任国家级医疗器械生产检查员的公告》,新聘52人为国家医疗器械检查员,分布在全国多个省份。
根据《关于建立职业化专业化药品药品检查员队伍的意见》,这种职业化专业化医疗器械检查员是指经药品监管部门认定,依法对管理相对人从事药品研制、生产等场所、活动进行合规确认和风险研判的人员。
这也就意味着,今年这种不打招呼直奔现场的检查频次将会越来越高!可想而知,在越来越全方位的检查下,医疗器械行业将迎来最强监管时代。
为了进一步加强医疗器械生产经营监管工作,科学合理配置监管资源,9月9日,国家药监局综合司发布了《关于加强医疗器械生产经营分级监管工作的指导意见》。
《指导意见》明确,血液透析设备、造影导管、引导导管等84种医疗器械,纳入生产重点监管品种目录;穿刺包、血袋、输液器等47种医疗器械,纳入医疗器械经营重点监管品种目录。自2023年1月1日起正式施行。
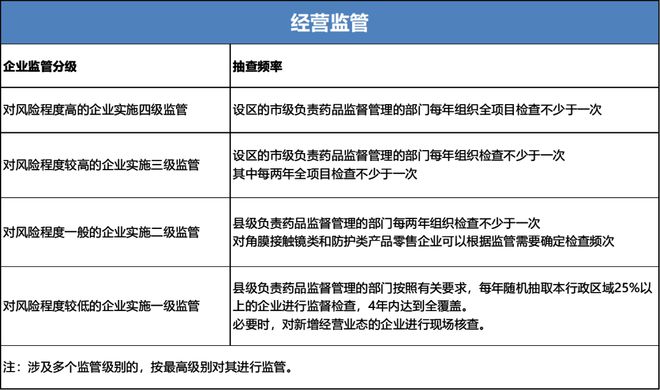
值得注意的是,该文件提出了对医疗器械生产经营企业的监管级别划分原则和检查要求,药品监管部门可以按照风险将医疗器械企业划分为四个监管级别,对不同监管级别的企业实施相应监管措施。

另外,《指导意见》还提出了对于监管级别可实施动态调整,即每年可结合监督检查、监督抽验、不良事件监测、产品召回、投诉举报和案件查办等情况,可对企业的监管级别实施动态调整。
对于长期以来监管信用状况较好的企业,可以酌情下调监管级别, 对于以委托生产方式或者通过创新医疗器械审评审批通道取得产品上市许可,以及跨区域委托生产的医疗器械注册人,仅进行受托生产的受托生产企业,国家集中带量采购中选产品的医疗器械注册人备案人、受托生产企业应当酌情上调监管级别。
未来,飞检、暗访亦或是交叉检查都已成为国家对医疗器械监管的常规方法,无论是监管级别的动态调整还是抽检频率的提升,面对层层严格的检查标准,作为医械企业,唯一做的就是在每一个环节严格要求自身,定期自检自查。也只有这样,才能在一轮又一轮的整治风暴中稳住脚跟。

